Granatapfelpolyphenole hemmen Prostatakrebs
Klinische und präklinische Daten über die Wirkung von Granatapfelpolyphenolen
Dr. med. Ludwig Manfred Jacob
Schlüsselwörter: Granatapfel, Polyphenole, Prostatakrebs, Hormonrefraktärität, Synergismus, Lebendfermentation
Zusammenfassung
Granatapfelpolyphenole zeigten in in-vitro-, in-vivo- und klinischen Studien eine überzeugende Hemmung der Kanzerogenese (Initiation, Promotion, Progression), des Wachstums und der Invasion durch antiangiogenetische, redifferenzierende, antiproliferative und proapoptotische Effekte. Hierfür verantwortlich ist das natürliche Zusammenspiel der antiinflammatorischen, antioxidativen, antiöstrogenen Polyphenole, die das Immunsystem, das Epigenom und die Zellsignalwege modulieren. Hierbei finden keine Veränderungen der Androgen- oder Östrogen-Spiegel statt. Neben einer großen Vielzahl präklinischer Studien gibt es bislang eine kontrollierte klinische Langzeit-Studie mit Prostatakrebspatienten, die eine durchschnittliche Vervierfachung der PSA-Verdoppelungszeit über eine Behandlungszeit von 56 Monaten ergab. Besonders interessant sind neue präklinische Ergebnisse, die auf mögliche Synergieeffekte mit Hormonablation, Chemo- und Strahlentherapie bei der Therapie des hormonrefraktären Prostatakarzinoms hinweisen. Zu beachten sind Unterschiede in Bezug auf Qualität, Stabilität und Gehalt der Polyphenole von Granatapfelprodukten, wobei fermentierte Granatapfelpolpyhenole eine höhere Bioaktivität und Bioverfügbarkeit aufweisen. Insbesondere werden neue Wirkmechanismen in Bezug auf die Hemmung von CYP-Enzymen, die mögliche Konzentrationssteigerung von 3ß-Adiol und Aktivierung des antiproliferativen Östrogenrezeptors beta sowie eine Antagonisierung des proliferativen Östrogenrezeptors alpha durch Granatapfelpolpyhenole vorgestellt.
Durch die vielseitigen positiven und in klinischen Studien belegten Wirkungen von Granatapfelpolyphenolen gegen Herz-Kreislauf-Erkrankungen und Diabetes ergibt sich eine Möglichkeit, dem unter Hormonentzugstherapie erhöhten Risiko für diese Erkrankungen entgegenzuwirken.
Der Artikel beinhaltet zum Teil bereits veröffentlichte Informationen (vgl. Jacob LM und Klippel KF (2008): Granatapfelpolyphenole gegen Prostatakarzinom, Deutsche Zeitschrift für Onkologie; 40:112–119) sowie neue Studien und Erkenntnisse.
Prostatakrebs ist mit 25% aller auftretenden Tumore die häufigste Krebsart bei Männern in Deutschland – vor Darm- und Lungenkrebs. Das Prostatakarzinom ist meistens ein typisches, langsam wachsendes Alterskarzinom. Daher ist es besonders wichtig, die Zeit zur Metastasierung zu verlängern, damit der Patient möglichst lange eine hohe Lebensqualität genießt und nicht an seinem Prostatakrebs, sondern mit seinem Prostatakrebs verstirbt. Hier bieten Lifestylemaßnahmen, wie regelmäßiger, am besten auch intensive Bewegung und Ernährungsmaßnahmen einen vielversprechenden Ansatz.
Nicht nur Betroffene mit «low risk“ Karzinomen, die sich für «active surveillance“ (aktives Beobachten) entschieden haben, sondern auch Männer mit PSA-Rezidiven nach Primärtherapie wünschen häufig ihren Gesundheitszustand aktiv durch Veränderungen ihrer Lebens- und Ernährungsweise zu verbessern.Granatapfelpolyphenole verfügen hierbei über vielseitige antikanzerogene Wirkmechanismen.
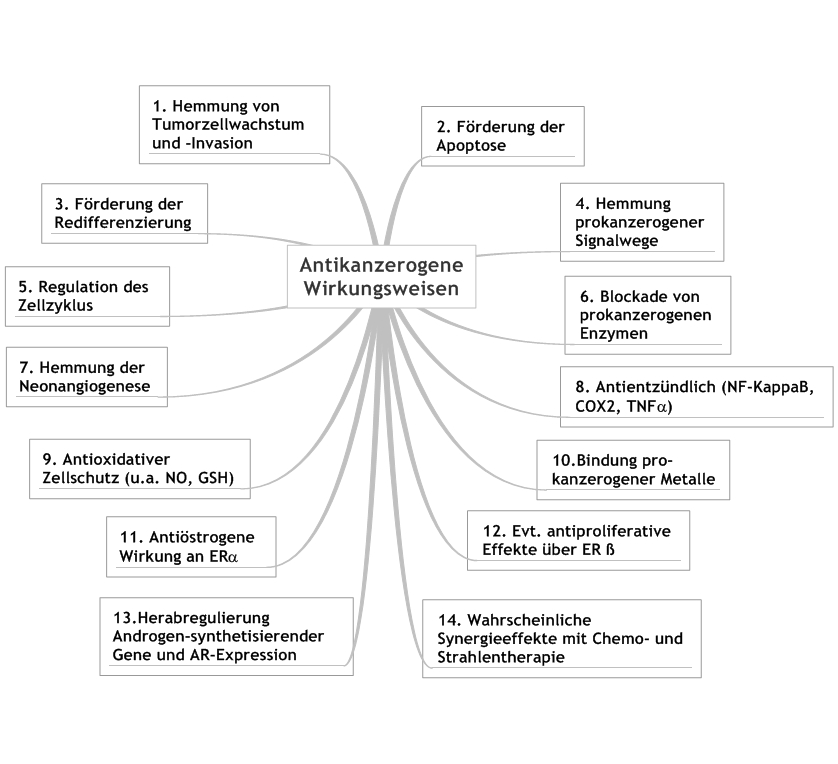
Spektrum antikanzerogener Wirkungen
- Verringerung von Tumorproliferation und -invasion
- Erhöhung der Apoptoserate von Tumorzellen, vermittelt durch Kaspasen und mitochondriale Signalwege
- Förderung der Redifferenzierung von Leukämiezellen
- Hemmung proliferativer, prokanzerogener Signalwege durch Phosphorylierungshemmung der MAP-Kinasen, c-met und AKT-Kinase sowie Aktivierungshemmung von mTOR
- Regulation des Zellzyklus durch Arretierung in der G0-G1 Phase, Induktion der Gene p21 und p27Kip1, Reduktion der Proteinexpression von Zyklin D1, D2 und E sowie der zyklin-abhängigen Kinasen
- Blockade von prokanzerogenen Enzymen: Matrix-Metalloproteasen, Aromatase und 17-alpha-Hydroxysteroiddehydrogenase, Ornithindecarboxylase und CYP-Enzymen
- Verminderung der Neoangiogenese
- Regulation und Hemmung von entzündlichen Prozessen durch Hemmung von COX-2, NF-kappaB, TNF-alpha und Proteinkinasen wie MAPK
- Zellschutz gegenüber freien Radikalen durch antioxidative Wirkung und deutliche Erhöhung des Gesamt-Antioxidantien-Status, insbesondere GSH
- Bindung von potentiell prokanzerogenen Metallen und Bildung von Metall-Polyphenol-Komplexen mit Anti-Krebswirkung
- Antiöstrogene Wirkung auf den proliferativen Östrogenrezeptor alpha; Hemmung der östrogenbildenden Schlüsselenzyme Aromatase und 17-alpha-Hydroxysteroid-Dehydrogenase; überwiegend antiöstrogene Wirkung bei Brustkrebszellen
- Möglicherweise Steigerung des antiproliferativen Östrogenrezeptor-ß-Agonisten 3-ß-Adiol durch Cyp-7B1-Hemmung (in vitro)
- Herabregulierung der Expression androgen-synthetisierender Enzyme und des Androgenrezeptors beim Prostatakarzinom
- Wahrscheinliche Synergieeffekte mit Chemo- und Strahlentherapie durch NF-kappaB-Aktivierungshemmung und Durchbrechung der Apoptoseresistenz von Tumorstammzellen
Klinische Studien belegen Verlängerung der PSA-Verdoppelungszeit nach PSA-Rezidiv
Auf dem Krebskongress der American Society of Clinical Oncology (ASCO) wurden im Juni 2011 die Ergebnisse einer aktuellen Studie von Paller et al. [81] vorgestellt, die die Wirksamkeit von Granatapfel-Antioxidantien bei Prostatakrebs belegt. In der doppelblinden randomisierten Studie wurde 104 Prostatakrebspatienten nach erfolgloser Primärtherapie (PSA-Rezidiv) Granatapfel-Extrakt verabreicht und der PSA-Verdopplungszeitraum beobachtet. Die PSA-Verdoppelungszeit wird immer häufiger als wichtiger Surrogat-Biomarker für die Mortalität beim Prostatakarzinom nach Operation oder Bestrahlung angesehen. Je langsamer der PSA-Wert (Prostataspezifisches Antigen) ansteigt, desto länger ist in der Regel die Lebenserwartung. In der Studie hatten die Teilnehmer im Schnitt ein Alter von 74,5 Jahren und einen Prostatakrebs von mittlerer Aggressivität mit Gleason-Score 7.
Schon durch die tägliche Aufnahme von Granatapfel-Extrakt über 6 Monate verlängerte sich die mittlere PSA-Verdopplungszeit von 11,9 auf 18,5 Monate. Bei 43 % der Studienteilnehmer konnte diese Zeitspanne im Vergleich zum Ausgangswert am Beginn der Studie sogar verdoppelt werden, bei 13% wurden fallende PSA-Werte festgestellt. Signifikante Veränderungen der Testosteronwerte gab es nicht. Metastasen traten bei keinem Teilnehmer auf. Als einzige Nebenwirkung berichteten 8 % der Teilnehmer über milde bis mittlere Diarrhö.
Zwischen der Einnahme von Granatapfel-Extrakt mit täglich ca. 600 mg Gesamtphenole (nach Folin-Ciocalteu als Gallussäure-Äquivalent) des Studien-Granatapfelextrakts [82] und der dreifachen Menge ergab sich kein signifikanter Unterschied.
Anstieg der PSA-Verdoppelungszeit von 15 auf 60 Monate in klinischer Langzeitstudie
In einer zunächst über 33 Monate laufenden, einarmigen klinischen Studie [1] verlängerte der tägliche Verzehr von 1 Glas Granatapfelsaft (570 mg als Gesamtphenole nach Folin-Ciocalteu als Gallussäure-Äquivalent) den Zeitraum, in dem sich der Spiegel des Prostata-spezifischen Antigens (PSA) verdoppelte, von 15 auf 55 Monate – die fast vierfache Zeit. Alle Patienten hatten trotz vorheriger Prostataektomie oder Bestrahlung ein PSA-Rezidiv. Die PSA-Verdoppelungszeit wird immer häufiger als wichtiger Surrogat-Biomarker für die Mortalität beim Prostatakarzinom nach Operation oder Bestrahlung angesehen. 94 % der Teilnehmer hatten einen mittleren Gleason-Score von 5–7 sowie keine nachgewiesene Metastasierung.
Zum Endpunkt der 33-monatigen Studienzeit nahmen noch 46 Männer an der Studie teil. Bei 83 % bewirkte Granatapfelsaft einen absoluten PSA-Abfall oder eine signifikante Verlangsamung der PSA-Verdoppelungszeit. Unter den Respondern gab es große Unterschiede in der Wirkung: Während die PSA-Verdopplungszeit vor Studienbeginn 15,6 Monate (+/- 10,8 Monate, Median 11,5 Monate) betrug, verlängerte sie sich während der Studie auf 54,7 Monate (+/-102 Monate, Median 28,7 Monate, P<0,001). Insgesamt erreichten 16 Patienten (35 %) einen Abfall des PSA-Wertes um durchschnittlich 27 %, 4 davon hatten einen PSA-Abfall über 50 %. Keiner der Studienteilnehmer entwickelte eine Metastasierung in der Studienzeit von 33 Monaten. Eine reine Maskierung des PSA-Werts ist sehr unwahrscheinlich. So hatten bei gesunden Männern ohne Prostatakrebs Granatapfelsaft und Ellagsäure keinen Einfluss auf den PSA-Wert. In Bezug auf IGF-1, Testosteron, Estradiol, SHBG und Androstenedion (Estradiol-Vorläufer) sowie Dehydroepiandrosteron (DHEA = Vorstufe von Androgenen und Östrogenen) wurden keine Veränderungen während der Pantuck-Studie festgestellt.
Pantuck deutet die fehlende Wirkung auf den Hormonspiegel als Hinweis darauf, dass die Wirkung von Granatapfel-Polyphenolen nicht in erster Linie hormoneller Natur sei, sondern auf deren antiinflammatorischen und antioxidativen Wirkung beruht.
Verglichen mit den Ausgangswerten bei Studienbeginn bewirkte das Serum der Krebskranken ex vivo eine 12 %-Reduktion des Wachstums in LNCaP-Prostatakrebszellkulturen (84 % Responder). In Zellkulturen verursachte das Serum eine durchschnittliche Erhöhung der Apoptose um 17,5 % (75 % Responder).
Bei Patienten, die bis Ende 2008 im Median 56 Monate an der Studie teilgenommen haben, verlängerte sich unter Granatapfelsaft die PSA-Verdopplungszeit sogar auf durchschnittlich 60 Monate (5 Jahre). Der PSA slope fiel dabei im Median um 60 % [2]. Die Studie wird derzeit unter Beteiligung des National Cancer Instituts in verschiedenen Krebszentren in den USA als Phase-3-Studie fortgeführt. Nach Aussage des Sprechers der American Urological Association, Dr. Christopher Amling, legt die Studie nahe, dass Granatapfelsaft nach erfolgloser Behandlung wirksam die Progression von Prostatakrebs verlangsamen könne. «Diese Ergebnisse und andere laufende Forschungen dürften eines Tages zeigen, dass Granatapfelsaft auch ein wirksames Mittel zur Vorbeugung von Prostatakrebs sei.“
Erhebliche Response-Unterschiede aufgrund der Bioverfügbarkeit
Eine weitere Schlussfolgerung der Langzeitanalyse: Eine Untergruppe der Patienten profitierte besonders von der Einnahme des Granatapfels. Die nähere Auswertung der Pantuck-Studie zeigte große Unterschiede in der Ansprechrate der Studienteilnehmer. 83 % waren Responder, jedoch gab es bei der durchschnittlich erreichten PSA-Verdoppelungszeit von 55 Monaten eine Schwankungsbreite von ± 102 Monate, was zeigt, dass der Saft bei einigen Teilnehmern ganz hervorragend, bei anderen nur mäßig anschlug.
Die ganz erheblichen interindividuellen Wirkunterschiede (in vivo und ex vivo) sind wohl nicht nur auf eine unterschiedliche Tumorbiologie zurückzuführen, sondern auch auf die individuell sehr unterschiedliche Bioverfügbarkeit der Granatapfelpolyphenole. Auch in Bioverfügbarkeitsstudien wurden erhebliche individuelle Unterschiede festgestellt, die auf die Zusammensetzung der Darmflora zurückgeführt wurden [3]. Die Ellagsäure ist der Grundbaustein der Ellagitannine, welche mengenmäßig die wichtigste Gruppe der Granatapfel-Polyphenole darstellen. Das Punicalagin ist das wichtigste Ellagitannin, das nach vollständiger Hydrolyse in drei Ellagsäuremoleküle zerfällt. Die biologische Wirkung des Saftes ist zum Großteil den aglykonen Metaboliten der Darmflora zuzuschreiben, nicht der direkten Wirkung von Polyphenolen im Saft. Als besondere Ellagsäure-Metaboliten sind wahrscheinlich die sogenannten Urolithine von großer Bedeutung.
Östrogene und antiöstrogene Wirkungen
Urolithine haben eine hohe Affinität zum proliferativ wirksamen Östrogenrezeptor alpha und können schon bei sehr niedrigen Konzentrationen antiöstrogen und antiproliferativ wirksam sein [4]. Auch von der Ellagsäure (Ausgangsstoff der Urolithine) ist eine SERM (Selective Estrogen Response Modifier)-artige Wirkung als Antiöstrogen bekannt [5]. Mäusen oral verabreichte Urolithine reichern sich vor allem in der Prostata an, gefolgt von Kolon und Darmgewebe. Ihre Xenograft-Prostatakarzinome werden gehemmt. Ellagsäure und noch deutlich wirkungsvoller die Urolithine hemmen in vitro das Prostatakrebszellwachstum [6].
Im Granatapfelsaft sind auch verschiedene Flavonoide wie z.B. Kaempferol, Quercetin, Naringenin und Luteolin vorhanden [7]. Mengenmäßig sind die Ellagitannine die wichtigste Polyphenol-Stoffgruppe. Jedoch dürfte letztlich die Synergie aller Pflanzenstoffe (wie auch Gallussäure, Tannine, Anthocyane) für die besondere Gesamtwirkung des Granatapfels verantwortlich sein.
Durch Lebendfermentation lassen sich Bioverfügbarkeit und Bioaktivität steigern.
Die Stoffwechselleistung fermentativer Mikroorganismen ersetzt zum Teil eine mangelhafte humane Metabolisierung, indem die hochmolekularen Granatapfelpolyphenole in niedermolekulare, besser resorbierbare Metaboliten transformiert werden. Zuckerbindungen der Polyphenole und Zuckergehalt werden abgebaut. Die krebshemmende Wirkung fermentierter Granatapfelsaft-Polyphenole war in Studien ausgeprägter als bei unfermentierten Zubereitungen.
Bei der Hemmung der Proliferation und Invasion von hormonabhängigen und hormonrefraktären Prostatakrebszellen erwies sich der fermentierte Granatapfelsaft gegenüber unfermentiertem deutlich überlegen [8–10]. Im Vergleich zu Frischsaft bremsten fermentierte Granatapfelpolyphenole doppelt so stark das Wachstum von Brustkrebszellen, hemmten die Schlüsselenzyme Aromatase und 17β-Hydroxysteroid- Dehydrogenase (17β-HSD) und dadurch die Östrogen-Biosynthese im Fettgewebe [11], was sowohl für Mamma- als auch Prostatakarzinome von Bedeutung ist. Eine amerikanische Forschungsgruppe [12] bestätigte, dass der Granatapfelmetabolit Urolithin B schon in geringen Dosen von 2,35 bis 4,7 µmol/l eine antiproliferative Wirkung auf hormonabhängigen Brustkrebs haben und damit möglicherweise das Brustkrebsrisiko senken können.
In fermentierter Form konnten Granatapfelpolyphenole die Neoangiogenese effektiv vermindern [13] sowie Leukämiezellen zur Redifferenzierung bringen und die Apoptose induzieren [14]. Diabetiker profitieren von fermentierten Granatapfelprodukten besonders, denn durch die Fermentation wird der fruchteigene Zucker drastisch reduziert.
Wirkungen beim hormonrefraktären Prostatakarzinom
Die zunehmende Androgen-Unabhängigkeit von Prostatakarzinomen unter Hormonblockade stellt ein großes therapeutisches Problem dar und führt zur Entstehung besonders aggressiver Karzinome. Die Androgen-Unabhängigkeit ist oft Folge eines mutierten, hypersensitiven oder überexprimierten Androgenrezeptors und einer verstärkten Bildung von Enzymen, die in der Krebszelle aus Cholesterin Androgene synthetisieren.
Granatapfelpolyphenole beeinflussen das Krebsgeschehen auch im hormonrefraktären Stadium:
– Granatapfelpolyphenole drosseln die Expression des in diesem Stadium häufig überexprimierten
Androgenrezeptors [15, 16].
– Granatapfelpolyphenole verringern die Bildung von Androgensynthese-Enzymen in hormonrefraktären
Krebszellen [16].
– Granatapfelpolyphenole senken intrazelluläre Cholesterinspiegel [17] und damit den Ausgangsstoff für die
gesteigerte Androgen-Biosynthese.
– Fermentierte Granatapfelpolyphenole hemmen das Krebswachstum von hormonrefraktären
PC-3-Prostatakarzinomen in vivo und wirken in vitro bei hormonrefraktären PC-3- und DU145-
Prostatakarzinomzellen antiproliferativ und antiinvasiv [8].
– Die antiinflammatorische Wirkung der Granatapfelpolyphenole (Hemmung von NF-kappaB, COX-2,
TNF-alpha und Metalloproteasen) ist in diesem Stadium besonders wichtig.
Hemmung der Androgenrezeptor-Expression und Androgensynthese
In einer Studie der Universität von Wisconsin [15] hemmte ein gefriergetrocknetes Granatapfelsaftextrakt effektiv das Wachstum von hochaggressiven, hormonrefraktären PC3-Prostatakarzinomzellen und führte zur Apoptose. Bei androgenabhängigen Krebszellen wurde sowohl die Expression des Androgenrezeptors als auch die PSA-Produktion um 90 % gedrosselt. Bei Mäusen wurden antikanzerogene Effekte bereits bei einer für den Menschen verzehrüblichen Menge erreicht: Der PSA sank deutlich, die Prostatakarzinome wuchsen signifikant langsamer als in der Kontrollgruppe und die mittlere Überlebenszeit verlängerte sich um 50 %.
Hong und Mitarbeiter veröffentlichten im Mai 2008 [16] folgende neue Perspektiven: In Prostatakrebszellen mit Überexpression des Androgenrezeptors (LNCaP-AR) hemmten Granatapfelpolyphenole die Expression des Androgenrezeptors. In diesen Krebszellen und in besonders aggressiven, hormonrefraktären DU-145-Prostatakarzinomzellen hemmten Granatapfelpolyphenole effektiv die Expression der Schlüsselenzyme der Androgen-Biosynthese. Damit könnten diese auch bei den schwer therapierbaren Androgen-unabhängigen Prostatakarzinomen mit überexprimiertem Androgenrezeptor und hochregulierten Androgensynthese-Enyzmen wirksam sein und möglicherweise eine synergistische Kombination mit der Hormonblockade darstellen.
Dies ist besonders interessant, weil in metastasierenden Prostatakarzinomen bei chemisch oder chirurgisch kastrierten Männern alle Enzyme, die für die Synthese von Testosteron und Dihydrotestosteron (DHT) aus Cholesterin notwendig sind, verstärkt exprimiert werden. Auf diese Weise können diese Karzinome trotz sehr niedrigen Androgen-Blutspiegels überleben [18].
Granatapfelsaftpolyphenole haben in einer klinischen Studie eine cholesterinsenkende Wirkung gezeigt [19] und senken in Makrophagen intrazellulär den Cholesterin-Spiegel durch verminderte Aufnahme, gesteigerte Ausscheidung und reduzierte Biosynthese [17]. Damit geht den Krebszellen das für die Androgensynthese essentielle Cholesterin zum Teil verloren. In der Cholesterinsenkung sicherlich wirkungsvoller, aber auch nebenwirkungsreicher sind Statine, die zu einer signifikanten Risikoreduktion für das lokal fortgeschrittene und metastasierende Prostatakarzinom führen [20].
Wirkung auf Zellsignalwege, Genexpression und Genregulation
Heute geht man immer mehr davon aus, dass der regelmäßige Verzehr von Obst und Gemüse durch eine Modulation der Zellsignalwege und des Epigenoms vor Krebs und Herz-Kreislauf-Erkrankungen schützen kann [21, 22]. Auch die besondere Wirkung der Granatapfelpolyphenole ist wohl auf komplexe Synergie-Effekte zurückzuführen: Das natürliche Stoffgemisch kommuniziert – bildlich gesprochen – mit Zellen und Zellsignalwegen. Hierfür reichen vergleichsweise geringe Mengen aus, während für direkte chemische Wirkungen hohe Wirkstoffkonzentrationen im Gewebe erreicht werden müssen.
So zeigte die Forschergruppe aus Wisconsin in sechs Studien, wie gefriergetrocknetes Saftextrakt Krebs in vitro und in vivo hemmte, indem es Genregulation, Genexpression sowie vielfältige antikanzerogene Signalwege beeinflusste [15, 23–27]:
a) Hemmung proliferativer, prokanzerogener Signalwege
– durch Phosphorylierungshemmung von MAP-Kinasen, c-met, Akt-Kinase, Phosphatidylinositol-3-Kinasen (PI3K), – Aktivierungshemmung von mTOR
– Hemmung von Markern der Zellproliferation (z. B. Ki-67 und PCNA)
b) Hemmung von Markern der Angiogenese (z. B. CD31 und VEGF)
c) Förderung der Apoptose durch Aktivitätssteigerung von Caspasen und Tumorsuppressorgenen
(z. B. p53)
d) Regulation des Zellzyklus durch
– Dosis-abhängige Arretierung des Zellzyklus in der G0-G1-Phase
– Induktion der Gene WAF1/p21 und KIP1/p27, dadurch Hemmung zyklin-abhängiger Kinasen und
Förderung der Zellregulation und Apoptose
– Reduktion der Proteinexpression von Zyklin D1, D2 und E sowie der zyklin-abhängigen Kinasen (CDK2, CDK4, CDK6)
e) Initiale Hemmung der Entzündungskaskade durch NF-kappaB-Aktivierungshemmung
Die oben genannten Ergebnisse stammen überwiegend aus zwei Studien [26, 27], in denen Lungenadenome und -adenokarzinome bei Mäusen erzeugt wurden: Das gefriergetrocknete Granatapfelsaftextrakt reduzierte die Tumormasse um 62 % (nach 140 Tagen) und 66 % (nach 240 Tagen) im Vergleich zur Kontrollgruppe. An humanen A549-Lungenkarzinomzellen wurden ähnliche Effekte festgestellt, wobei gesunde Zellen nicht beeinträchtigt wurden.
Wie beschrieben, hemmen Granatapfelpolyphenole die Aktivität vieler proliferativ wirkender Proteinkinasen durch eine Phosphorylierungshemmung. Die Proteinphosphorylierung ist ein sehr wichtiger Kontrollmechanismus in der Signaltransduktion der Zelle. Beim hormonrefraktären Prostatakarzinom ist der PI3K/Akt-Signalweg aktiviert und führt häufig zu einer Phosphorylierung des Androgenrezeptors. Akt ist eine Serin/Threonin-Kinase, die das Überleben, die Proliferation und den Sterbezyklus der Zelle reguliert. McCall et al. [28] zeigten, dass nur der phosphorylierte Androgenrezeptor mit einer verkürzten Überlebenszeit bei Patienten mit hormonrefraktärem Prostatakarzinom assoziiert ist. Eine andere Studie [29] ergab, dass Akt insbesondere unter Hormonblockade unabhängig vom Androgenrezeptor das Überleben der Karzinomzelle ermöglicht. Unter Androgen-Entzug stimuliert die Krebszelle die Akt-Phosphorylierung und Aktivierung, um ihr Überleben auf diesem Androgen-unabhängigen Signalweg sicherzustellen. Granatapfelpolyphenole hemmen sowohl die Akt- als auch die MAPK-Phosphorylierung und damit deren Aktivierung. Dies könnte auch die Ursache für eine Herabregulation des Androgenrezeptors sein.
Dass Granatapfelpolyphenole das androgen-unabhängige Prostatakrebswachstum mittels eines NF-kappaB-abhängigen Mechanismus in vitro und in vivo hemmen und den Übergang in die Hormonrefraktarität verlangsamen, wurde in einer in-vivo-Studie [30] nachgewiesen.
Aufgrund der Eigenschaft von Granatapfelpolyphenolen, die Expression des Androgenrezeptors und androgen-synthetisierender Enzyme herabzuregulieren, bei Proteinkinasen eine Phosphorylierungshemmung und in Krebszellen die Apoptose insbesondere über eine NF-kappaB-Aktivierungshemmung zu fördern, könnte eine Kombination mit der Hormonablation sehr interessante Synergie-Effekte bewirken und die Bildung von Resistenzen verzögern. Dies muss sich noch in der klinischen Praxis bewähren.
Mögliche Wirkung von Granatapfelpolyphenolen gegen Prostatakrebsstammzellen
Bei Entzündungsprozessen wird der nukleäre Faktor kappaB (NF-kappaB) aktiviert. Die Aktivierung von NF-kappaB wirkt auf direkte und indirekte Weise dem nekrotischen und apoptotischen Zelltod entgegen und ist auch ein entscheidender Faktor in der Immortalisierung von malignen Krebsstammzellen. Normale, geschädigte Stammzellen zerstören sich durch Apoptose selbst, ihr genetischer Schaden kann nicht zu einem Krebszellklon proliferieren. Stammzellen mit NF-kappaB-Aktivierung sind jedoch durch die Apoptosehemmung unsterblich.
Die antiinflammatorische Wirkung der Granatapfelpolyphenole erfolgt u. a. über eine Hemmung der COX-2-, TNF-alpha-Expression, eine Hemmung von Metalloproteasen und eine Aktivierungshemmung von NF-kappaB [23–27, 31–34]. NF-kappaB ist ein zentraler Transkriptionsfaktor, der die Expression von fast 400 verschiedenen proentzündlichen und z. T. prokanzerogenen Genen reguliert.
Insbesondere beim hormonrefraktären Prostatakarzinom geraten NF-kappaB-Inhibitoren zunehmend in den Focus der Forschung. NF-kappaB ist für die Kanzerogenese des Prostatakarzinoms in jedem Stadium von zentraler Bedeutung und wird umso wichtiger, je weniger Therapieoptionen verbleiben [35].
Der Zusammenhang zwischen NF-kappaB-Aktivierung und Therapieresistenz bei Chemo- und Strahlentherapie ist in Studien beobachtet worden. Bei der akuten myeloischen Leukämie (AML) ist nachgewiesen, dass nur eine kleine Untergruppe der AML-Zellen mit einem Stammzell-Immunophänotyp in der Lage ist, Leukämie bei der Übertragung auf NOD/SCID-Mäuse auszulösen. Diese Zellen sind besonders chemo- und strahlenresistent. Diese Leukämiestammzellen wiesen als einzigen Unterschied eine konstitutive Aktivierung von NF-kappaB auf [36].
Birnie et al. [37] verglichen Biopsien von gesundem und bösartigem Prostatagewebe. Genexpressionsprofile von 581 Genen wurden erstellt und die Expressionsmuster mit RT-PCR, Flow-Zytometrie und Immunozytochemie validiert. Ein besonders deutlicher Unterschied war die Hochregulierung von Entzündungsgenen wie Interleukin 6 und NF-kappaB beim Krebsgewebe. Ein Hemmstoff von NF-kappaB zeigte eine gezielte proapoptotische Wirkung auf Krebsstammzellen, während gesunde Stammzellen nicht beeinträchtigt wurden. Die Schlussfolgerung der Studie: NF-kappaB ist ein Hauptfaktor, der die Apoptoseresistenz von Krebsstammzellen kontrolliert und damit ein attraktives Ziel chemopräventiver und chemotherapeutischer Interventionen ist.
Nach einer Studie von Lansky und Kawaii [14] führten fermentierte Granatapfelsaftpolyphenole bei HL-60-Leukämiezellen zur Redifferenzierung oder Apoptose. Der reine Frischsaft wies nur eine geringe redifferenzierende Wirkung auf. Die Redifferenzierung bestätigt die oben beschriebenen Zusammenhänge, dass sich normale Leukozyten nur durch NF-kappaB-Aktivierung von Leukämiezellen unterscheiden.
Mögliche Synergie zwischen Chemo- und Strahlentherapie mit Granatapfelpolyphenolen durch NF-kappaB-Aktivierungshemmung
Die Radiotherapie ist eine der Säulen der Primärtherapie und verursacht eine strahleninduzierte NF-kappaB-Aktivierung, die zu einer Apoptoseresistenz der Krebszellen führen kann. Bei Prostatakarzinomen im hormonrefraktären Stadium spielt die palliative Chemotherapie mit Docetaxel eine wichtige Rolle. Eine erhöhte Entzündungsaktivität ist hier ein starker Prädiktor für ausgeprägte Nebenwirkungen, eine geringere Überlebensrate und ein vermindertes Ansprechen auf Docetaxel [38]. Eine Entzündungshemmung könnte die Therapieresultate verbessern und Nebenwirkungen vermindern [39]. Positive Synergieeffekte von Entzündungshemmern und Taxanen sind in präklinischen Studien nachgewiesen [40].
Allerdings ist die Kombination von Docetaxel und entzündungshemmenden, höher konzentrierten Granatapfelpolyphenolen nur unter ärztlicher Kontrolle empfehlenswert. Die Inaktivierung von Docetaxel erfolgt über das Enzym CYP3A4 der Cytochrom-P450-Familie, dessen Expression durch Granatapfelpolyphenole möglicherweise reduziert wird. Granatapfelpolyphenole können daher u. U. bei prädisponierten Patienten die Wirkspiegel von Docetaxel erhöhen.
In einer klinischen Studie von Falsaperla et al. [41] ergab die Supplementierung mit Ellagsäure, das wichtigste Monomer der Granatapfel-Polyphenole, eine Reduktion der Toxizität und der Neutropenie bei der Chemotherapie (Vinorelbin und Estramustin) von Patienten mit hormonrefraktären Prostatakrebs.
Sicherlich ist die mögliche Synergie von Granatapfelpolyphenolen mit Strahlen- und Chemotherapie ein lohnenswertes und wichtiges Forschungsfeld. Denn zum einen dürften Granatapfelpolyphenole die Nebenwirkungen auf gesunde Zellen im Sinne eines Zellschutzes senken, zum anderen wirken sie der Apoptose-Resistenz der NF-kappaB-aktivierten Tumorzellen entgegen und machen sie für Strahlen- und Chemotherapie angreifbar [42].
Fallbeispiel Synergie Chemo / fermentierte Granatapfelpolyphenole:
Der Patient (Jahrgang 38) leidet seit dem Jahr 2000 an einem in das Knochenmark metastasierten Prostatakarzinom und erhielt folgende Therapie:
1. Chemo 08/2005–11/05: 25 mg/qm Körperoberfläche Doxetacel plus Avastin (5 mg/kg/KG).
Mäßiger Abfall des PSA-Wertes von 349 auf 235 mg/l
2. Chemo 07/2006–02/2007: 25 mg/qm Körperoberfläche Doxetacel und Avastin (5 mg/kg/KG) plus 20 ml Granatapfel-Elixier (ca. 500 mg Polyphenole). Abfall des PSA-Wertes von 1185 auf 120 mg/l. Danach Erhaltung mit Estramustin/Etoposid/Cyclophosphamid und Granatapfel-Elixier.
Absetzen von Erhaltungs-Chemo 05/08. Keine weitere Einnahme von Elixier ab Juli 08.
Deutlicher Anstieg von PSA 262 mg/l (Juli 08) auf 2208 mg/l (Januar 09).
Neuer Chemo-Zyklus (Doxetacel plus Avastin) und erneute Einnahme von Elixier (10 ml) und Granaprostan (2 ´ 500 mg). Seit 02/09 auch Einnahme von Citrat-Basenpulver (Knochenstabilisierung, Ausleitung Tumormilchsäure), Colostrum und Enzymen. Deutlich besseres Allgemeinempfinden und Abfall des PSA-Wertes auf 900 mg/l (28,05 2009).
Der Allgemeinzustand des Patienten verschlechterte sich nach einer Lymphadenektomie mit Infektion dramatisch, an deren Folgen er am 12. Juni 2009 leider verstarb.
Tumorzellinvasion
Circa 90 % aller Krebskranken sterben an der Metastasierung. Ein zentraler erster Schritt ist die Proteolyse der extrazellulären Matrix durch Metalloproteasen. Ein gefriergetrocknetes Granatapfelsaftextrakt hemmte diese Metalloproteasen [33]. In Studien [8–10] zeigten fermentierte und unfermentierte Granatapfelpolyphenole sowie Samenöl eine drastische Hemmung der Tumorzellinvasion. Die Wirkung erfolgt bei hormonsensitiven (LNCaP) und hormonrefraktären (DU-145, PC-3) Prostatakarzinomzellen. Auch in vivo hemmten fermentierte Granatapfelpolyphenole signifikant das Wachstum von hormonrefraktären PC-3-Prostatakarzinomzellen [8].
Neoangiogenese
Fermentierte Granatapfelsaftpolyphenole verhinderten in vivo effektiv die Neubildung von Tumorgefäßen, während Schalenextrakte sich als deutlich weniger wirksam erwiesen [13]. In einer aktuellen Studie hemmte auch ein ellagitanninreiches Granatapfelextrakt die Angiogenese von Prostatakarzinomen in vitro (bei LNCaP-Zellen) und in vivo [43]. Insbesondere Kupfer unterstützt die Neoangiogenese.
Bindung potentiell prokanzerogener Metalle
Metalle wie Kupfer, Eisen, Chrom, Vanadium, Cadmium, Arsen und Nickel können in entsprechenden Konzentrationen die Kanzerogenese fördern, indem sie freie Radikale bilden und zu Mutationen führen [44]. Die Werte von Kupfer im Serum scheinen bei vielen Krebsarten erhöht und korrelieren mit dem Erkrankungsrisiko [45] sowie dem Ausmaß des Karzinoms und der Prognose. Kupferwerte von Darm- und Prostatakrebskranken sind gegenüber Gesunden deutlich erhöht [46]. Kupfer wirkt zytotoxisch, erzeugt oxidativen Stress und chronische Entzündungsreaktionen u. a. über NF-kappaB und TNF-alpha [47, 48] und stimuliert die Bildung von Tumorgefäßen [49]. Therapeutisch verhindern Chelatoren die Hemmung der Kupferaufnahme und reduzieren deutlich das Prostatakrebswachstum und die Neoangiogenese [50].
Katechine und Phenolsäuren, wie sie auch im Granatapfel enthalten sind, bilden mit Kupfer einen Kupfer-Polyphenol-Komplex. Dieser scheint als Prooxidans zur Zellapoptose zu führen und so eine antikanzerogene Wirkung zu entfalten [51, 52]. Da Kupfer vor allem im Krebsgewebe erhöhte Konzentrationen aufweist, könnte dies ein Grund für die selektive zytotoxische Wirkung des Kupfer-Polyphenol-Komplexes auf Krebszellen sein [53]. Insbesondere Prostatakarzinomzellen weisen hohe Kupferkonzentrationen auf und lassen sich z. B. durch einen Komplex von Kupfer und dem Antioxidans Pyrrolidindithiocarbamat (PDTC) gezielt abtöten [54].
Punicalagin, das mengenmäßig wichtigste Granatapfelpolyphenol, cheliert u. a. Kupfer und Eisen, ohne an DNA zu binden [55]. Auch das Punicalagin-Monomer, die Ellagsäure, zeigt ähnliche Wirkungen als Chelator von Kupfer [56] und Nickel [57].
Während therapeutisch die hohe Kupferkonzentration in Karzinomen möglicherweise von Nutzen sein kann, ist es präventiv vorteilhaft, die Aufnahme von Kupfer als potentielles Prokanzerogen über die Ernährung (z. B. Wasserleitungen aus Kupfer, Amalgam-Füllungen mit hohem Kupferanteil, Nahrungsergänzungsmittel) gering zu halten.
Konzentrationssteigerung von NO und reduziertem L-Glutathion (GSH)
Granatapfelpolyphenole können als hochpotente in-vivo-Antioxidantien der Kanzerogenese entgegenwirken. Reduziertes L-Glutathion (GSH) ist das wichtigste intrazelluläre Antioxidans und für die Zelle absolut lebenswichtig. Zahlreiche entzündliche und neoplastische Erkrankungen gehen mit einer verminderten intrazellulären GSH-Konzentration einher. Dass Granatapfelsaft deutlich die intrazelluläre GSH-Konzentration steigert, wurde an Menschen in klinischen Studien gezeigt, so z. B. in Makrophagen (z. B. 71 % GSH-Anstieg bei Diabetikern [58]), in arteriosklerotischen Karotis-Plaques (z. B. 250 % GSH-Anstieg [59]).
Der Nobelpreisträger Luis Ignarro, der die Bedeutung von Stickstoffmonoxid (NO) für den menschlichen Organismus aufklärte, wies im Jahr 2006 nach, dass Granatapfelsaft die biologische Wirksamkeit und Wirkdauer von NO erhöht und das Molekülradikal gleichzeitig durch antioxidative Mechanismen stabilisiert [60]. Bei Prostatakarzinom-Patienten stieg NO im Serum unter Granatapfelsaftkonsum durchschnittlich um 23 % an [1].
In einer klinischen Studie stieg nach regelmäßigem Konsum von einem Glas Granatapfelsaft über ein Jahr der Gesamtantioxidantien-Status im Blut (TAS) um 130 % [59].
Auch diese Effekte sind wohl mehr auf die epigenetische Wirksamkeit des Granatapfels als Zellregulator [61] zurückzuführen als auf die direkte antioxidative Wirkung.
Hemmung der Zytochrom-P450-Enzyme als chemopräventiver Mechanismus
Erhöhte Aktivität und Expression von Zytochrom (CYP)-Enzymen steigern die Giftungsrate von Prokanzerogenen, erhöhen damit das Erkrankungsrisiko und verschlechtern die Prognose. Pflanzenstoffe, die eine Hemmwirkung auf CYP-450-Phase-I-Enzyme bzw. eine aktivierende Wirkung auf entgiftende Phase-II-Enzyme besitzen, sind in der Chemoprävention von Bedeutung [62, 63].
Zytochrom-P450-Enzym CYP1B1 ist belegtes Ziel der Chemoprävention bei Prostatakrebs, da CYP1B1-Hemmstoffe günstige Effekte auf allen Stufen der Kanzerogenese sowie gegen die Entwicklung von Therapieresistenzen haben. Punicalagine, die Hauptpolyphenole des Granatapfels, hemmen CYP1A1 und dürften für die Darmschleimhaut eine chemopräventive Wirkung haben. Urolithine sind die tatsächlich im Blut anwesenden Metaboliten des fermentativen intestinalen Abbaus von Granatapfel-Ellagitanninen. Sie senken sowohl die Aktivität von CYP1B1 als auch dessen Expression [64].
Im Tierversuch an Mäusen ging nach 4-wöchiger Granatapfelsaftgabe der CYP-450-Gehalt in der Leber der Versuchstiere um 43 % zurück. Zudem wurde eine Hemmung der Expression von CYP1A2 und CYP3A4 auf m-RNA-Ebene beobachtet [65].
Zytochrom-Hemmung und potenzielle Arzneimittelinteraktionen
Eine Zytochrom-Hemmung kann bei entsprechender Medikation und genetischer Disposition auch problematisch werden. Denn zahlreiche Zytochrom-Enzyme, (v.a. CYP3A4) sind eng in die Biotransformation von Arzneimitteln involviert, so dass deren Hemmung eine Wirkverstärkung bzw. -verlängerung bedeuten könnte.
Inwieweit Granatapfelpolyphenole klinisch relevante Arzneimittelinteraktionen verursachen, ist noch nicht hinreichend untersucht. Das Ausmaß scheint jedoch im Vergleich zu anderen Fruchtzubereitungen wie Grapefruitsaft gering zu sein. In einer Untersuchung an humanen Lebermikrosomen wurde die direkte Hemmwirkung von Granatapfelsaft auf das Schlüsselenzym CYP3A4 anhand der Midazolam-1-Hydroxylierungsaktivität in humanen Lebermikrosomen gemessen. Hierbei zeigte Granatapfelsaft im Vergleich zu anderen Obstsäften nur eine sehr geringe Hemmwirkung. Die Hemmung wurde mit absteigender Intensität wie folgt gemessen: Grapefruit > schwarze Maulbeere > wilde Trauben > Granatapfel [66]. Im bereits erwähnten Tierversuch war die Beeinflussung der Pentobarbital-induzierten Schlafzeit nicht signifikant [65].
Im Zellexperiment zeigte sich eine Hemmung von CYP3A und bei Ratten eine Veränderung der Pharmakokinetik von Carbamazepin [67].
Dagegen zeigte sich in einer Humanstudie keine Hemmung von CYP3A – im Gegensatz zu Grapefruitsaft: Die Pharmakokinetik von Midazolam blieb unverändert [68].
In der Literatur wird von einem einzelnen Fall einer möglichen Interaktion mit Cholesterinsenkern berichtet. Der Patient, der Ezetimib und Rosuvastatin einnahm, litt möglicherweise bereits vor dem Konsum von 200 ml Granatapfelsaft an einer Myopathie (CK von 659 U/L). Statine und wohl auch Ezetimib können Myopathien und Rhabdomyolysen verursachen. Ob nun die beiden Cholesterinsenker selbst, deren Interaktion oder die zusätzliche Interaktion mit dem Granatapfelsaft für die Rhabdomyolyse des Patienten verantwortlich waren, ist aus dieser Einzelfallbeschreibung nicht ersichtlich [69].
Über zwei mögliche, nicht eindeutige Fälle einer Wirkungsverstärkung von Warfarin wird in der Literatur berichtet (83, 84). Eine einschleichende Dosierung unter INR-Kontrolle ist empfehlenswert.
Weiter relativiert wird dieser unklare Einzelfall durch die Tatsache, dass Granatapfelsaft in den USA bereits seit über 8 Jahren der populärste Gesundheitstrank ist und entsprechend reichhaltig auch von Personen mit kardiovaskulären Erkrankungen und medikamentös behandelter Hypercholesterinämie konsumiert wird. Insgesamt dürfte daher die Interaktion von Granatapfelsaft mit Arzneimitteln, wenn überhaupt vorhanden, gering sein. Dennoch sind bei besonderer genetischer Disposition, Medikamentenkombinationen und Krankheitsgeschehen Arzneimittelinteraktionen z.B. mit Antiarrhythmika, Statinen, Kalziumkanalblockern, Immunsuppressiva, Kumarine Warfarin/Marcumar, Taxanen oder Protease-Inhibitoren im Sinne einer Wirkungsverstärkung der Medikamente nicht ganz auszuschließen.
Mögliche Steigerung des antiproliferativen Östrogenrezeptor-ß-Agonisten 3ß-Adiol durch CYP-7B1-Hemmung
Die beiden Östrogenrezeptorsubtypen ER alpha und ER beta erfüllen in der Prostata verschiedene Aufgaben: ER alpha wirkt im Stroma über die Ausschüttung von Wachstumsfaktoren proliferativ auf das Prostataepithel. Er ist auch in den Basalzellen der wichtigste Östrogenrezeptor mit proliferativer Funktion. ER ß ist verantwortlich für die Hemmung der Proliferation und Förderung der Zelldifferenzierung des sekretorischen Prostataepithels. ER ß senkt die Expression von AR und ER alpha 3ß-Adiol ist ein Abbauprodukt von DHT und in der Prostata der wohl wichtigste endogene Ligand von ER ß. Nach dem ER ß-Entdecker Jan-Ǻke Gustafsson gleicht 3ß-Adiol in der Prostata über ER ß mit seiner antiproliferativen, differenzierenden Wirkung den proliferativen Effekt von Östrogenen (am ER alpha) und DHT (am AR) aus. Der Spiegel von 3β-Adiol in der Prostata werden durch die Expression der beiden Enzyme HSD17B3 (Bildung) und CYP7B1 (Abbau) reguliert.
In vitro bewirkt ein gefriergetrocknetes, fermentiertes Granatapfelsaftpulver die Inhibition von CYP7B1 (Nachweis anhand der 7 alpha-Hydroxylierung von DHEA). DHEA und 3ß-Adiol sind Substrate von CYP7B1 und werden nach demselben Mechanismus inaktiviert. Ein Rückgang der DHEA-Hydroxylierung lässt also auch auf eine potentielle Inaktivierungshemmung von 3ß-Adiol durch die Testsubstanz schließen. Als Vergleich wurden zusätzliche Inkubationen mit Ellagsäure durchgeführt. Dabei zeigte sich eine stark konzentrationsabhängige Hemmung der 7-alpha-Hydroxylierung von DHEA. Die Ellagsäure zeigte überraschenderweise auch bei hohen Konzentrationen keine nennenswerte Hemmung, während das fermentierte Granatapfelpulver bis zu einer Konzentration von 0,025 % (Masse/Volumen) wirksam war.
In Bezug auf Testosteron, Estradiol und DHEA wurden in der klinischen Studie von Allan Pantuck keine Veränderungen zwischen vor und nach Studienintervention festgestellt. Allerdings schließt dies nicht aus, dass es in der Prostata zu einer Anreicherung von Granatapfelwirkstoffen (vgl. [70]) kommt, die lokal zu einer entsprechenden Hemmung der CYP7B1 und Konzentrationssteigerung von 3ß-Adiol führen, während sie aber nicht deutliche Änderungen der Serumspiegel von 3ß-Adiol und DHEA verursachen.
Sollte es auch in vivo zu der hier in vitro nachgewiesenen Hemmung der CYP7B1 kommen, würde dies über einen verminderten Abbau zur Konzentrationssteigerung von 3ß-Adiol führen und damit eine protektive, antiproliferative Wirkung im Prostataepithel ausüben – eine bisher nicht erkannte, aber wichtige neue Wirkungsweise von Granatapfelpolyphenolen. Auch könnte dieser Effekt den häufiger beobachteten, aber in Studien noch nicht untersuchten günstigen Einfluss von fermentierten Granatapfelpolyphenolen auf die benigne Prostatahyperplasie erklären.
Konsequenzen für die ärztliche Praxis
Insgesamt ist eine abschließende Beurteilung der Studienlage zu Granatapfelpolyphenolen gegenwärtig nicht möglich, wenn die Ergebnisse auch vielversprechend sind. Eine Empfehlung von Granatapfelsaftpolyphenolen zur Prävention und adjuvanten Ernährungstherapie des Prostatakarzinoms ist jedoch gerechtfertigt. Besonders Männer, die keine kurative Behandlung wünschen, sondern lieber beobachtend abwarten (active surveillance), können durch solche alimentäre Maßnahmen und eine gesundes Lebensweise aktiv Verantwortung für den Verlauf ihrer Erkrankung übernehmen. In Abhängigkeit von der individuellen Tumorbiologie und Bioverfügbarkeit dürfte eine zum Teil deutliche Verlangsamung der Krebsprogression und positive Nebenwirkungen auf Herz und Gefäße zu erwarten sein, was bei einem Alterskarzinom einen Gewinn von entscheidenden Lebensjahren bedeuten kann.
Positive Nebenwirkungen auf Herz und Gefäße [71]:
• Signifikante Verbesserung der Myokarddurchblutung bei KHK-Patienten (doppelblinde, placebo-kontrollierte, randomisierte Phase-2-Studie, [72])
• Reduktion von arteriosklerotischen Gefäßablagerungen und Bluthochdruck (Placebo-kontrollierte, randomisierte Phase-2-Studie an Patienten mit Karotisstenose, [59]), verlangsamte Progredienz der Karotis-Intima-Dicke-Zunahme bei Patienten mit erhöhten Triglyzerid- und Cholesterinwerten in einer Placebo-kontrollierten, randomisierten Studie mit 291 Patienten [73].
• antiatherogene und cholesterinsenkende Wirkung bei Diabetikern (ohne Einfluss auf HbA1c und Blutzucker) in klinischen Studien [19, 58], verbesserte Erektion bei Patienten mit erektiler Dysfunktion [74]
Insbesondere unter Hormonentzugstherapie können diese heilsamen Wirkungen auf das Herz-Kreislauf-System und eine diabetische Stoffwechsellage lebenswichtig werden. Denn hier zeigen immer mehr große Studien, dass der Androgenentzug das Risiko an Diabetes und Herz-Kreislauf-Erkrankungen zu erkranken und an plötzlichem Herztod zu sterben, deutlich steigert. So ergab z. B. eine Untersuchung an 73.196 Männern unter Androgenentzug mit GnRH-Agonisten eine Steigerung des Diabetesrisikos um 44 %, des Risikos für koronare Herzkrankheit um 16 %, für Herzinfarkt und plötzlichen Herztod um je 16 % [75].
Eine hochaktuelle Studie mit 37.443 Prostatakrebspatienten, die 2010 im Journal des National Cancer Instituts publiziert wurde, zeigt [76]: Die Behandlung mit GnRH-Agonisten erhöhte verglichen mit den nicht mit Androngeentzug behandelten Patienten das Risiko für Diabetes um 28 %, für koronare Herzkrankheit um 19 %, für Herzinfarkt um 28 % und plötzlichen Herztod um 35 % sowie für Schlaganfall um 22 %. Die Orchiektomie ging einher mit einem 40 % höheren Risko für koronare Herzkrankheit und einem 111 % höheren Risiko für Herzinfarkt verglichen mit Prostatakrebspatienten, die keine Hormonblockade und Hodenentfernung hatten.
Granatapfelpolyphenole bewirken weder eine sichere Heilung noch ersetzen sie eine notwendige kurative Behandlung. Doch können sie Standard-Therapien wirkungsvoll ergänzen und wahrscheinlich in ihrem Wirkungs- und Nebenwirkungsprofil verbessern.
Qualität: Ein Problem bei Granatapfelsäften sind Verfälschungen. Bekanntlich enthalten ein großer Teil der Getränke, die angeblich zu 100 % aus Granatapfelsaft bestehen, Zusatz von Zucker, Farbstoffen und/oder anderen minderwertigen Fruchtsäften. Der aromatisch-fruchtig-herbe Geschmack ist ein wichtiges Kennzeichen. Ein wichtiger Marker für die Verwendung fauler Granatäpfel oder minderwertiger Fremdfrüchte ist Sorbit. Auch echte Granatapfelprodukte weisen aufgrund der Herstellungsverfahren und Früchte große Unterschiede in der Qualität und im Gehalt an wirksamen Polyphenolen auf. Dies betrifft nicht nur die Säfte (Säfte aus Konzentrat 897 bis 4265 mg/l Polyphenole, Median 2288 mg/l; Frisch/Direktsäfte 904 bis 2067 mg/l, Median 1409 mg/ nach Folin-Ciocalteu-Methode als Catechin-Äquivalent [77]), sondern auch Granatapfelextrakte, in denen die Polyphenole aufgrund der Hitzetrocknung häufig in hochpolymerisierter, oxidierter Form mit zweifelhafter Bioverfügbarkeit und unvollständigem Polyphenolspektrum vorliegen. Vorzuziehen sind schonende Trocknungsverfahren wie die Gefriertrocknung. Bei auf 40 % Ellagsäure standardisierten Granatapfel-Extrakten wird die Ellagsäure meistens künstlich zugesetzt [78]. Bei vielen Kapseln sind die Polyphenolangaben nicht vorhanden oder hinsichtlich der Messmethode nicht mit Studien vergleichbar (Messmethode nach Folin-Ciocalteu als Gallussäure-Äquivalent). Die Verzehrempfehlungen sind daher meist zu niedrig.
Einnahmemenge: Die meisten in Deutschland und der Schweiz momentan erhältlichen Granatapfelsäfte haben keinen standardisierten Polyphenolgehalt. Empfehlenswert sind täglich zirka 300 – 600 mg Polyphenole (gemessen nach Folin-Ciocalteu als Gallussäure-Äquivalent) zur Gesunderhaltung. Bei bestehendem Prostatakarzinom ist es besonders wichtig, ein Granatapfelprodukt mit standardisiertem und stabilem Polyphenolgehalt und dem vollen natürlichen Polyphenolspektrum einzunehmen. Hier sollten wie in den klinischen Studien täglich mindestens 570 mg verzehrt werden, wobei lebendfermentierte Polyphenole eine höhere Bioaktivität aufweisen.
Ob größere Mengen auch mehr bewirken, ist unklar. In der Prävention ist dies zu verneinen, beim Karzinom durch größere zytostatische Effekte durchaus denkbar. Sehr hochdosierte, zytostatische Dosen von Polyphenolen sollten unter ärztlicher Kontrolle der Leber- und Nierenwerte eingenommen werden.
Die Bioverfügbarkeit von Polyphenolen ist am höchsten, wenn sie separat von den Hauptmahlzeiten verzehrt werden [79]. Tannine binden an Proteine und fällen diese aus. Dies kann sich negativ auf die Bioverfügbarkeit der Polyphenole auswirken.
In der Pantuck-Studie wurde bei 83 % der Studienteilnehmer eine signifikante Verlangsamung des PSA-Anstiegs festgestellt, die über lange Zeit anhielt. Da sich die Tumorbiologie im Laufe der Zeit, insbesondere auch unter Hormonblockade, verändert, können Wirkstoffe ihre Wirkung verlieren. Sollte daher nach einigen Jahren der PSA-Wert plötzlich deutlich schneller ansteigen, sollten andere Maßnahmen in Erwägung gezogen werden. Wird durch Granatapfelsaft keine Wirkung erzielt, sind fermentierte, bioaktivere Granatapfelpolyphenole eine zweite Option. (Allerdings ist bei neuroendokrinen Prostatakarzinomen auf PSA kein Verlass.)
Resümee: Im Dschungel der vielfältigen Ernährungsempfehlungen beim Prostatakarzinom ist der Granatapfel die Frucht mit der besten Studienevidenz und sehr günstigen protektiven «Nebenwirkungen“ auf das Herz-Kreislauf-System und andere Krebserkrankungen [80]. Die klinische und präklinische Datenlage rechtfertigt den Verzehr von Granatapfelsaftpolyphenolen in der adjuvanten Ernährungstherapie und Chemoprävention von Prostatakrebs. Neuste Forschungsergebnisse zeigen interessante Perspektiven bezüglich des hormonrefraktären Prostatakarzinoms auf. Der Granatapfel bildet möglicherweise eine sinnvolle, synergistische Ergänzung zu Standardtherapien.
Literatur
1 Pantuck AJ, Leppert JT, Zomorodian N, Aronson W, Hong J, Barnard RJ, Seeram N, Liker H, Wang H, Elashoff
R, Heber D, Aviram M, Ignarro L, Belldegrun A: Phase II study of pomegranate juice for men with rising
prostate-specific antigen following surgery or radiation for prostate cancer. Clin Cancer Res
2006;12:4018–4026.
2 Pantuck AJ, Zomorodian Z, Rettig M, Aronson W, Heber D, Belldegrun A: Long term follow up of phase 2
study of pomegranate juice for men with prostate cancer shows durable prolongation of PSA doubling time. J
Urol 2009;181(suppl 1):295.
3 Cerdá B, Espín JC, Parra S, Martínez P, Tomás-Barberán FA: The potent in vitro antioxidant ellagitannins from
pomegranate juice are metabolised into bioavailable but poor antioxidant hydroxy-6H-dibenzopyran-6-one
derivatives by the colonic microflora of healthy humans. Eur J Nutr 2004;43:205–220.
4 Larrosa M, González-Sarrías A, García-Conesa MT, Tomás-Barberán FA, Espín JC: Urolithins, ellagic
acid-derived metabolites produced by human colonic microflora, exhibit estrogenic and antiestrogenic
activities. J Agric Food Chem 2006;54:1611–1612.
5 Papoutsi Z, Kassi E, Tsiapara A, Fokialakis N, Chrousos GP, Moutsatsou P: Evaluation of
estrogenic/antiestrogenic activity of ellagic acid via the estrogen receptor subtypes ERalpha and ERbeta. J
Agric Food Chem 2005;53:7715–7720.
6 Seeram NP, Aronson WJ, Zhang Y, Henning SM, Moro A, Lee RP, Sartippour M, Harris DM, Rettig M, Suchard
MA, Pantuck AJ, Belldegrun A, Heber D: Pomegranate ellagitannin-derived metabolites inhibit prostate cancer
growth and localize to the mouse prostate gland. J Agric Food Chem 2007;55:7732–7737.
7 Kim ND, Mehta R, Yu W, Neeman I, Livney T, Amichay A, Poirier D, Nicholls P, Kirby A, Jiang W, Mansel R,
Ramachandran C, Rabi T, Kaplan B, Lansky E: Chemopreventive and adjuvant therapeutic potential of
pomegranate (Punica granatum) for human breast cancer. Breast Cancer Res Treat 2002;71:203–217.
8 Albrecht M, Jiang W, Kumi-Diaka J, Lansky EP, Gommersall LM, Patel A, Mansel RE, Neeman I, Geldof AA,
Campbell MJ: Pomegranate extracts potently suppress proliferation, xenograft growth, and invasion of human
prostate cancer cells. J Med Food 2004;7:274–283.
9 Lansky EP, Jiang W, Mo H, Bravo L, Froom P, Yu W, Harris NM, Neeman I, Campbell MJ: Possible synergistic
prostate cancer suppression by anatomically discrete pomegranate fractions. Invest New Drugs
2005;23:11–20.
10 Lansky EP, Harrison G, Froom P, Jiang WG: Pomegranate (Punica granatum) pure chemicals show possible
synergistic inhibition of human PC-3 prostate cancer cell invasion across Matrigel. Invest New Drugs
2005;23:121–122.
11 Kim DO, Lee KW, Lee HL, Lee CY: Vitamin C equivalent antioxidant capacity (VCEAC) of phenolic
phytochemicals. J Agric Food Chem 2002;50:3713–3717.
12 Adams LS, Zhang Y, Seeram NP, Heber D, Chen S: Pomegranate ellagitannin-derived compounds exhibit
antiproliferative and antiaromatase activity in breast cancer cells in vitro. Cancer Prev Res (Phila Pa)
2010;3:108–113.
13 Toi M, Bando H, Ramachandran C, Melnick SJ, Imai A, Fife RS, Carr RE, Oikawa T, Lansky EP: Preliminary
studies on the anti-angiogenic potential of pomegranate fractions in vitro and in vivo. Angiogenesis
2003;6:121–128.
14 Kawaii S, Lansky EP: Differentiation-promoting activity of pomegranate (Punica granatum) fruit extracts in
HL-60 human promyelocytic leukemia cells. J Med Food 2004;7:13–18.
15 Malik A, Afaq F, Sarfaraz S, Adhami VM, Syed DN, Mukhtar H: Pomegranate fruit juice for chemoprevention
and chemotherapy of prostate cancer. Proc Natl Acad Sci U S A 2005;102:14813–14818.
16 Hong MY, Seeram NP, Heber D: Pomegranate polyphenols down-regulate expression of androgen-
synthesizing genes in human prostate cancer cells overexpressing the androgen receptor. J Nutr Biochem
2008;19:848–855.
17 Fuhrman B, Volkova N, Aviram M: Pomegranate juice inhibits oxidized LDL uptake and cholesterol
biosynthesis in macrophages. J Nutr Biochem 2005;16:570–576.
18 Montgomery RB, Mostaghel EA, Vessella R, Hess DL, Kalhorn TF, Higano CS, True LD, Nelson PS: Maintenance
of intratumoral androgens in metastatic prostate cancer: a mechanism for castration-resistant tumor growth.
Cancer Res 2008;68:4447–4454.
19 Esmaillzadeh A, Tahbaz F, Gaieni I, Alavi-Majd H, Azadbakht L: Cholesterol-lowering effect of concentrated
pomegranate juice consumption in type II diabetic patients with hyperlipidemia. Int J Vitam Nutr Res
2006;76:147–151.
20 Platz EA, Leitzmann MF, Visvanathan K, Rimm EB, Stampfer MJ, Willett WC, Giovannucci E: Statin drugs and
risk of advanced prostate cancer. J Natl Cancer Inst 2006;98:1819–1825.
21 Milner JA: Molecular targets for bioactive food components. J Nutr 2004;134:2492S–2498S.
22 Milner JA: Diet and cancer: facts and controversies. Nutr Cancer 2006;56:216–224.
23 Afaq F, Malik A, Syed D, Maes D, Matsui MS, Mukhtar H: Pomegranate fruit extract modulates UV-B-mediated
phosphorylation of mitogen-activated protein kinases and activation of nuclear factor kappaB in normal
human epidermal keratinocytes paragraph sign. Photochem Photobiol 2005;81:38–45.
24 Afaq F, Saleem M, Krueger CG, Reed JD, Mukhtar H: Anthocyanin- and hydrolyzable tannin-rich pomegranate
fruit extract modulates MAPK and NF-kappaB pathways and inhibits skin tumorigenesis in CD-1 mice. Int J
Cancer 2005;113:423–433.
25 Syed DN, Malik A, Hadi N, Sarfaraz S, Afaq F, Mukhtar H: Photochemopreventive effect of pomegranate fruit
extract on UVA-mediated activation of cellular pathways in normal human epidermal keratinocytes.
Photochem Photobiol 2006;82:398–405.
26 Khan N, Afaq F, Kweon MH, Kim K, Mukhtar H: Oral consumption of pomegranate fruit extract inhibits growth
and progression of primary lung tumors in mice. Cancer Res 2007;67:3475–3482.
27 Khan N, Hadi N, Afaq F, Syed DN, Kweon MH, Mukhtar H: Pomegranate fruit extract inhibits prosurvival
pathways in human A549 lung carcinoma cells and tumor growth in athymic nude mice. Carcinogenesis
2007;28:163–173.
28 McCall P, Gemmell LK, Mukherjee R, Bartlett JM, Edwards J: Phosphorylation of the androgen receptor is
associated with reduced survival in hormone-refractory prostate cancer patients. Br J Cancer
2008;98:1094–1101.
29 Mikhailova M, Wang Y, Bedolla R, Lu XH, Kreisberg JI, Ghosh PM: AKT regulates androgen receptor-
dependent growth and PSA expression in prostate cancer. Adv Exp Med Biol 2008;617:397–405.
30 Rettig MB, Heber D, An J, Seeram NP, Rao JY, Liu H, Klatte T, Belldegrun A, Moro A, Henning SM, Mo D,
Aronson WJ, Pantuck A: Pomegranate extract inhibits androgen-independent prostate cancer growth through a
nuclear factor-kappaB-dependent mechanism. Mol Cancer Ther 2008;7:2662–2671.
31 Shukla M, Gupta K, Rasheed Z, Khan KA, Haqqi TM: Bioavailable constituents/metabolites of pomegranate
(Punica granatum L) preferentially inhibit COX2 activity ex vivo and IL-1beta-induced PGE2 production in
human chondrocytes in vitro. J Inflamm (Lond) 2008;5:9.
32 Huang TH, Yang Q, Harada M, Li GQ, Yamahara J, Roufogalis BD, Li Y: Pomegranate flower extract diminishes
cardiac fibrosis in Zucker diabetic fatty rats: modulation of cardiac endothelin-1 and nuclear factor-kappaB
pathways. J Cardiovasc Pharmacol 2005;46:856–862.
33 Ahmed S, Wang N, Hafeez BB, Cheruvu VK, Haqqi TM: Punica granatum L. extract inhibits IL-1beta-induced
expression of matrix metalloproteinases by inhibiting the activation of MAP kinases and NF-kappaB in human
chondrocytes in vitro. J Nutr 2005;135:2096–2102.
34 Schubert SY, Neeman I, Resnick N: A novel mechanism for the inhibition of NF-kappaB activation in vascular
endothelial cells by natural antioxidants. FASEB J 2002;16:1931–1933.
35 Nonomura N, Nakayama M, Takayama H, Nishimura K, Okuyama A: [Molecular-targeted therapy for prostate
cancer]. Hinyokika Kiyo 2008;54:63–66.
36 Griffin JD: Leukemia stem cells and constitutive activation of NF-kappaB. Blood 2001;98:2291.
37 Birnie R, Bryce SD, Roome C, Dussupt V, Droop A, Lang SH, Berry PA, Hyde CF, Lewis JL, Stower MJ,
Maitland NJ, Collins AT: Gene expression profiling of human prostate cancer stem cells reveals a
pro-inflammatory phenotype and the importance of extracellular matrix interactions. Genome Biol
2008;9:R83.
38 Charles KA, Rivory LP, Stockler MR, Beale P, Beith J, Boyer M, Clarke SJ: Predicting the toxicity of weekly
docetaxel in advanced cancer. Clin Pharmacokinet 2006;45:611–622.
39 Beer TM, Lalani AS, Lee S, Mori M, Eilers KM, Curd JG, Henner WD, Ryan CW, Venner P, Ruether JD, Chi KN;
ASCENT Investigators: C-reactive protein as a prognostic marker for men with androgen-independent
prostate cancer: results from the ASCENT trial. Cancer 2008;112:2377–2383.
40 Olsen SR: Taxanes and COX-2 inhibitors: from molecular pathways to clinical practice. Biomed Pharmacother
2005;59:306–310.
41 Falsaperla M, Morgia G, Tartarone A, Ardito R, Romano G: Support ellagic acid therapy in patients with
hormone refractory prostate cancer (HRPC) on standard chemotherapy using vinorelbine and estramustine
phosphate. Eur Urol 2005; 47:449–454.
42 Jacob LM, Klippel KF: Granatapfelpolyphenole gegen Prostatakarzinom. Dtsch Z Onkol 2008; 40:112–119.
43 Sartippour MR, Seeram NP, Rao JY, Moro A, Harris DM, Henning SM, Firouzi A, Rettig MB, Aronson WJ,
Pantuck AJ, Heber D: Ellagitannin-rich pomegranate extract inhibits angiogenesis in prostate cancer in vitro
and in vivo. Int J Oncol 2008;32:475–480.
44 Valko M, Rhodes CJ, Moncol J, Izakovic M, Mazur M: Free radicals, metals and antioxidants in oxidative
stress-induced cancer. Chem Biol Interact 2006;160:1–40.
45 Wu TJ, Sempos CT, Freudenheim JL, Muti P, Smith E: Serum iron, copper and zinc concentrations and risk of
cancer mortality in US adults. Ann Epidemiol 2004;14:195–201.
46 Nayak SB, Bhat VR, Upadhyay Dinesh, Udupa SL: Copper and ceruloplasmin status in serum of prostate and
colon cancer patients. Indian J Physiol Pharmacol 2003;47:108–110.
47 Kennedy T, Ghio AJ, Reed W, Samet J, Zagorski J, Quay J, Carter J, Dailey L, Hoidal JR, Devlin RB: Copper-
dependent inflammation and nuclear factor-kappaB activation by particulate air pollution. Am J Respir Cell Mol
Biol 1998;19:366–378.
48 Persichini T, Percario Z, Mazzon E, Colasanti M, Cuzzocrea S, Musci G: Copper activates the NF-kappaB
pathway in vivo. Antioxid Redox Signal 2006;8:1897–1904.
49 Lowndes SA, Harris AL: The role of copper in tumour angiogenesis. J Mammary Gland Biol Neoplasia
2005;10:299–310.
50 Brewer GJ, Dick RD, Grover DK, LeClaire V, Tseng M, Wicha M, Pienta K, Redman BG, Jahan T, Sondak VK,
Strawderman M, LeCarpentier G, Merajver SD: Treatment of metastatic cancer with tetrathiomolybdate, an
anticopper, antiangiogenic agent: Phase I study. Clin Cancer Res 2000;6:1–10.
51 Azmi AS, Bhat SH, Hanif S, Hadi SM: Plant polyphenols mobilize endogenous copper in human peripheral
lymphocytes leading to oxidative DNA breakage: a putative mechanism for anticancer properties. FEBS Lett
2006;580:533–538.
52 Malik A, Azam S, Hadi N, Hadi SM: DNA degradation by water extract of green tea in the presence of copper
ions: implications for anticancer properties. Phytother Res 2003;17:358–363.
53 Hadi SM, Bhat SH, Azmi AS, Hanif S, Shamim U, Ullah MF: Oxidative breakage of cellular DNA by plant
polyphenols: a putative mechanism for anticancer properties. Semin Cancer Biol 2007;17:370–376.
54 Chen D, Peng F, Cui QC, Daniel KG, Orlu S, Liu J, Dou QP: Inhibition of prostate cancer cellular proteasome
activity by a pyrrolidine dithiocarbamate-copper complex is associated with suppression of proliferation and
induction of apoptosis. Front Biosci 2005;10:2932–2939.
55 Kulkarni AP, Mahal HS, Kapoor S, Aradhya SM: In vitro studies on the binding, antioxidant, and cytotoxic
actions of punicalagin. J Agric Food Chem 2007;55:1491–1500.
56 Shimogaki H, Tanaka Y, Tamai H, Masuda M: In vitro and in vivo evaluation of ellagic acid on melanogenesis
inhibition. Int J Cosmet Sci 2000;22:291–303.
57 Ahmed S, Rahman A, Saleem M, Athar M, Sultana S: Ellagic acid ameliorates nickel induced biochemical
alterations: diminution of oxidative stress. Hum Exp Toxicol 1999;18:691–698.
58 Rosenblat M, Hayek T, Aviram M: Antioxidative effects of pomegranate juice (PJ) consumption by diabetic
patients on serum and on macrophages. Atherosclerosis 2006;187:363–371.
59 Aviram M, Rosenblat M, Gaitini D, Nitecki S, Hoffman A, Dornfeld L, Volkova N, Presser D, Attias J, Liker H,
Hayek T: Pomegranate juice consumption for 3 years by patients with carotid artery stenosis reduces
common carotid intima-media thickness, blood pressure and LDL oxidation. Clin Nutr 2004;23:423–433.
60 Ignarro LJ, Byrns RE, Sumi D, de Nigris F, Napoli C: Pomegranate juice protects nitric oxide against oxidative
destruction and enhances the biological actions of nitric oxide. Nitric Oxide 2006;15:93–102.
61 Jacob LM: Granatapfel als Zellregulator. Komplement Integr Med 2008;1:16–20.
62 Cavalieri E, Frenkel K, Liehr JG, Rogan E, Roy D: Estrogens as endogenous genotoxic agents-DNA-adducts
and mutations. J Natl Cancer Inst Monogr 2008;27:75–93.
63 Jefcoate CR, Liehr JG, Santen RJ, Sutter TR, Yager JD, Yue W, Santner SJ, Tekmal R, Demers L, Pauley R,
Naftolin F, Mor G, Berstein L: Tissue-specific synthesis and oxidative metabolism of estrogens. J Natl Cancer
Inst Monogr 2000;27:95–112.
64 Kasimsetty SG, Bialonska D, Reddy MK, Thornton C, Willett KL, Ferreira D: Effects of pomegranate chemical
constituents/intestinal microbial metabolites on CYP1B1 in 22Rv1 prostate cancer cells. J Agric Food Chem
2009;57:10636–10644.
65 Faria A, Monteiro R, Azevedo I, Calhau C: Pomegranate juice effects on cytochrome P450s expression: in
vivo studies. J Med Food 2007;10:643–649.
66 Kim H, Yoon YJ, Shon JH, Cha IJ, Shin JG, Liu KH: Inhibitory effects of fruit juices on CYP3A activity. Drug
Metab Dispos 2006;34:521–523.
67 Hidaka M, Okumura M, Fujita K, Ogikubo T, Yamasaki K, Iwakiri T, Setoguchi N, Arimori K: Effects of
pomegranate juice on human cytochrome p450 3A (CYP3A) and carbamazepine pharmacokinetics in rats.
Drug Metab Dispos 2005;33:644–648.
68 Farkas D, Oleson LE, Zhao Y, Harmatz JS, Zinny MA, Court MH, Greenblatt DJ: Pomegranate juice does not
impair clearance of oral or intravenous midazolam, a probe for cytochrome P450–3A activity: comparison
with grapefruit juice. J Clin Pharmacol 2007;47:286–294.
69 Sorokin AV, Duncan B, Panetta R, Thompson PD: Rhabdomyolysis associated with pomegranate juice
consumption. Am J Cardiol 2006;98:705–706.
70 Seeram NP, Henning SM, Zhang Y, Suchard M, Li Z, Heber D: Pomegranate juice ellagitannin metabolites are
present in human plasma and some persist in urine for up to 48 hours. J Nutr 2006;136:2481–2485.
71 Jacob LM: Granatapfel: Prävention und adjuvante Ernährungstherapie bei Herz-Kreislauf-Erkrankungen.
Erfahrungsheilkunde 2007;56:602–610.
72 Sumner MD, Elliott-Eller M, Weidner G, Daubenmier JJ, Chew MH, Marlin R, Raisin CJ, Ornish D: Effects of
pomegranate juice consumption on myocardial perfusion in patients with coronary heart disease. Am J
Cardiol 2005;96:810–814.
73 Davidson MH, Maki KC, Dicklin MR, Feinstein SB, Witchger M, Bell M, McGuire DK, Provost JC, Liker H,
Aviram M: Effects of consumption of pomegranate juice on carotid intima-media thickness in men and woman
at moderate risk for coronary heart disease. Am J Cardiol 2009;104:936–942.
74 Forest CP, Padma-Nathan H, Liker HR: Efficacy and safety of pomegranate juice on improvement of erectile
dysfunction in male patients with mild to moderate erectile dysfunction: a randomized, placebo-controlled,
double-blind, crossover study. Int J Impot Res 2007;19:564–567.
75 Keating NL, O’Malley AJ, Smith MR. Diabetes and cardiovascular disease during androgen deprivation therapy
for prostate cancer. J Clin Oncol. 2006 Sep 20;24(27):4448-56.
76 Keating NL, O’Malley AJ, Freedland SJ, Smith MR. Diabetes and cardiovascular disease during androgen
deprivation therapy: observational study of veterans with prostate cancer. J Natl Cancer Inst. 2010 Jan
6;102(1):39-46.
77 Fischer-Zorn M, Ara V: Granatapfelsaft – Chemische Zusammensetzung und mögliche Verfälschungen.
Flüssiges Obst 8/2007:386–393.
78 Lansky EP: Beware of pomegranates bearing 40% ellagic acid. J Med Food 2006;9:119–122.
79 Manach C, Scalbert A, Morand C, Rémésy C, Jiménez L: Polyphenols: food sources and bioavailability. Am J
Clin Nutr 2004;79:727–747.
80 Jacob LM: Granatapfel: Prävention und adjuvante Ernährungstherapie bei Krebserkrankungen.
Erfahrungsheilkunde 2007;56:464–473.
81 Paller CJ, Ye X, Wozniak P, Gillespie B, Sieber P, Greengold R, Stockton B, Hertzman B, Efros M, Roper R, Liker H, Carducci MA. A phase II study of pomegranate extract for men with rising prostate-specific antigen following primary therapy. ASCO Annual Meeting 2011, Poster Discussion Session.
82 Martin, Keith R.; Krueger, Christian G.; Rodriquez, Gerardo; Dreher, Mark; Reed, Jess D.Development of a novel pomegranate standard and new method for the quantitative measurement of pomegranate polyphenols. Journal of the Science of Food and Agriculture, Volume 89, Number 1, 15 January 2009 , pp. 157-162(6)
83 Komperda KE. Potential interaction between pomegranate juice and warfarin. Pharmacotherapy. 2009 Aug;29(8):1002-6.
84 Jarvis S, Li C, Bogle RG. Possible interaction between pomegranate juice and warfarin. Emerg Med J. 2010 Jan;27(1):74-5.
